Sifat Koligatif Larutan Elektrolit dan Non Elektrolit - Di alam bebas hampir tidak ditemukan zat cair murni 100 %. Hampir semua cairan yang ada di bumi berbentuk larutan atau campuran. Larutan merupakan campuran yang homogen, yaitu suatu campuran serba sama, antara zat terlarut (solute) dan zat pelarut (solvent), sehingga tidak dapat dibedakan satu sama lain. Adanya zat terlarut di dalam pelarut menyebabkan perubahan sifat fisik pada pelarut dan larutan tersebut. Sifat fisik yang mengalami perubahan misalnya penurunan tekanan uap, penurunan titik didih, kenaikan titik didih, dan tekanan osmosis.
Ada banyak hal yang menyebabkan larutan mempunyai sifat yang berbeda dengan pelarutnya. Salah satu sifat terpenting dari larutan adalah sifat koligatif larutan. Sifat koligatif didefinisikan sebagai sifat fisik larutan yang hanya ditentukan oleh jumlah partikel dalam larutan dan tidak tergantung jenis partikelnya.
Beberapa sifat koligatif yang akan dibicarakan dalam bab ini meliputi penurunan tekanan uap pelarut, penurunan titik beku larutan, kenaikan titik didih larutan, dan tekanan osmosis larutan. Misalnya kristal garam. Kristal garam diperoleh dari air laut yang diuapkan. Kristal garam tersebut, jika dilarutkan dalam air berubah menjadi partikel yang sangat kecil, sehingga garam dapat larut dalam air. Larutan garam merupakan campuran homogen.
Jumlah zat terlarut dalam suatu larutan dinyatakan dengan konsentrasi larutan. Konsentrasi menyatakan komposisi secara kuantitatif perbandingan zat terlarut dengan pelarut dan atau larutan. Ada beberapa cara untuk menyatakan secara kuantitatif komposisi tersebut, antara lain adalah molaritas, molalitas, dan fraksi mol. Ketiganya akan menjadi dasar untuk mempelajari sifat koligatif larutan, sehingga ketiganya harus dipelajari terlebih dahulu.
A. Molalitas dan Fraksi Mol
Dalam larutan, terdapat beberapa sifat zat yang hanya ditentukan oleh banyaknya partikel zat terlarut. Sifat ini disebut sebagai sifat koligatif larutan. Oleh karena sifat koligatif larutan ditentukan oleh banyaknya partikel zat terlarut, bab ini akan diawali dengan pembahasan mengenai konsentrasi larutan.
1. Molalitas
Pada pelajaran sebelumnya, kita menyatakan konsentrasi dengan persentase (%) dan molaritas (M). Dalam perhitungan molaritas, kuantitas larutan didasarkan pada volume. Anda tentu ingat, volume merupakan fungsi suhu (zat akan memuai ketika dipanaskan). Oleh karena sifat koligatif larutan dipengaruhi suhu, diperlukan suatu besaran yang tidak bergantung pada suhu. Besaran tersebut dinyatakan berdasarkan massa karena massa tidak bergantung pada suhu, baik dari kuantitas zat terlarut maupun pelarutnya. Untuk itu, digunakan molalitas yang menyatakan jumlah partikel zat terlarut (mol) setiap 1 kg pelarut (bukan larutan). Larutan yang dibuat dari 1 mol NaCl yang dilarutkan dalam 1.000 g air dinyatakan sebagai larutan 1 molal dan diberi lambang 1 m NaCl.
 |
| Gambar 1. Satuan konsentrasi molalitas memegang peranan penting dalam aktivitas di laboratorium |
Molalitas didefinisikan dengan persamaan berikut.
Keterangan :
m = molalitas (mol/kg)
Mr = massa molar zat terlarut (g/mol)
massa = massa zat terlarut (g)
p = massa zat pelarut (g)
Molalitas juga berguna pada keadaan lain, misalnya karena pelarut merupakan padatan pada suhu kamar dan hanya dapat diukur massanya, bukan volumenya sehingga tidak mungkin dinyatakan dalam bentuk molaritas. Perhatikanlah contoh soal penentuan molalitas berikut.
Contoh Soal 1 :
Sebanyak 30 g urea (Mr = 60 g/mol) dilarutkan ke dalam 100 g air. Hitunglah molalitas larutan!
Kunci Jawaban :
Jadi, molalitas larutan urea adalah 5 m.
Contoh Soal 2 :
Berapa gram NaCl yang harus dilarutkan dalam 500 g air untuk menghasilkan larutan 0,15 m?
Kunci Jawaban :
Molalitas artinya jumlah mol zat terlarut per kilogram pelarut. 0,15 m berarti 0,15 mol NaCl dalam 1 kg (1.000 g) air.
0,15 mol NaCl dalam 1.000 g H2O
Untuk menghitung jumlah mol NaCl yang diperlukan untuk 500 g H2O, kita dapat menggunakan hubungan tersebut sebagai faktor konversi. Kemudian, kita dapat menggunakan massa molar NaCl untuk mengubah mol NaCl menjadi massa NaCl.
Contoh Soal 3 :
Molalitas suatu larutan 20% berat C2H5OH (Mr = 46 g/mol) adalah....
Kunci Jawaban :
C2H5OH 20% artinya 20 gram
C2H5OH dalam 80 gram air :
Jadi, kemolalan larutan 20% berat C2H5OH adalah 5,4 m.
Contoh Soal 4 :
Berapakah kemolalan dari larutan 10% (w/w) NaCl? (w/w = persen berat)Kunci Jawaban :
Larutan 10% (w/w), artinya =
w berasal dari kata weight.
Untuk mengetahui kemolalan, kita harus mengetahui jumlah mol NaCl. 10 g NaCl dapat diubah menjadi mol dengan menggunakan massa molar NaCl (58,44 g/mol). Untuk mengetahui massa air, dapat dilakukan dengan cara pengurangan 100 g larutan NaCl oleh 10 g NaCl.
massa air = 100 g – 10 g = 90 g
Untuk menentukan kemolalan, dapat dilakukan konversi sebagai berikut.
Jadi, larutan 10% (w/w) NaCl memiliki konsentrasi 1,9 m.
2. Fraksi Mol
Fraksi mol merupakan satuan konsentrasi yang semua komponen larutannya dinyatakan berdasarkan mol. Fraksi mol komponen i, dilambangkan dengan xi adalah jumlah mol komponen i dibagi dengan jumlah mol semua komponen dalam larutan. Fraksi mol j adalah xj dan seterusnya. Jumlah fraksi mol dari semua komponen larutan adalah 1.
Total fraksi mol = xi + xj = 1
Perhatikanlah contoh soal penggunaan fraksi mol berikut.
Contoh Soal 4 :
Larutan glukosa dibuat dengan melarutkan 18 g glukosa (Mr = 180 g/mol) ke dalam 250 g air. Hitunglah fraksi mol glukosa.
Jadi, fraksi mol glukosa adalah 0,01.
Contoh Soal 5 :
Berapa fraksi mol dan persen mol setiap komponen dari campuran 0,2 mol O2 dan 0,5 mol N2?
Kunci Jawaban :
Fraksi mol N2 bisa juga dihitung dengan cara:
N2 x = 1 – O2 x
= 1 – 0,29 = 0,71
% mol O2 = 0,29 × 100% = 29%
% mol N2 = 0,71 × 100% = 71%
Jadi, fraksi mol O2 adalah 0,29 dan fraksi mol N2 adalah 0,71, sedangkan persen mol O2 adalah 29% dan persen mol N2 adalah 71%.
Contoh Soal 6 :
Fraksi mol suatu larutan metanol CH3OH dalam air adalah 0,50. Konsentrasi metanol dalam larutan ini jika dinyatakan dalam persen berat adalah ....
Kunci Jawaban :
mol metanol = mol air (misalkan 1 mol)
massa metanol = mol x Mr = 1 x 32 = 32
massa air = mol x Mr = 1 x 18 = 18
B. Sifat Koligatif Larutan Non Elektrolit
Meskipun sifat koligatif melibatkan larutan, sifat koligatif tidak bergantung pada interaksi antara molekul pelarut dan zat terlarut, tetapi bergantung pada jumlah zat terlarut yang larut pada suatu larutan. Sifat koligatif terdiri atas penurunan tekanan uap, kenaikan titik didih, penurunan titik beku, dan tekanan osmotik. Apakah perbedaan di antara keempat sifat koligatif tersebut? Perhatikanlah uraian berikut.
1. Penurunan Tekanan Uap
Penguapan adalah peristiwa yang terjadi ketika partikel-partikel zat cair meninggalkan kelompoknya. Semakin lemah gaya tarik-menarik antarmolekul zat cair, semakin mudah zat cair tersebut menguap. Semakin mudah zat cair menguap, semakin besar pula tekanan uap jenuhnya. Dalam suatu larutan, partikel-partikel zat terlarut menghalangi gerak molekul pelarut untuk berubah dari bentuk cair menjadi bentuk uap sehingga tekanan uap jenuh larutan menjadi lebih rendah dari tekanan uap jenuh larutan murni.
Dari eksperimen yang dilakukan Marie Francois Raoult (1878), didapatkan hasil bahwa melarutkan suatu zat terlarut menyebabkan penurunan tekanan uap larutan. Banyaknya penurunan tekanan uap (ΔP) terbukti sama dengan hasil kali fraksi mol zat terlarut (
Pada larutan yang terdiri atas dua komponen, pelarut A dan zat terlarut B,  maka
maka  . Apabila tekanan uap pelarut di atas larutan dilambangkan
. Apabila tekanan uap pelarut di atas larutan dilambangkan  ,
, 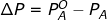 .
.
Persamaan akan menjadi:
Persamaan tersebut dikenal sebagai Hukum Raoult.
Tekanan uap pelarut ( ) sama dengan hasil kali tekanan uap pelarut murni (
) sama dengan hasil kali tekanan uap pelarut murni ( ) dengan fraksi mol pelarut dalam larutan (
) dengan fraksi mol pelarut dalam larutan ( ).
).
Apabila zat terlarut mudah menguap, dapat pula ditulis:
Tekanan uap total dapat ditulis:
Contoh Soal 7 :
Hitunglah tekanan uap larutan 2 mol sukrosa dalam 50 mol air pada 300 °C jika tekanan uap air murni pada 300 °C adalah 31,80 mmHg.
Kunci Jawaban :
= 0,962 × 31,8 mmHg = 30,59 mmHg
Jadi, tekanan uap larutan adalah 30,59 mmHg.
Contoh Soal 8 :
Berapakah tekanan uap parsial dan tekanan uap total pada suhu 25 °C di atas larutan dengan jumlah fraksi mol benzena (C6H6) sama dengan jumlah fraksi mol toluena (C7H8)? Tekanan uap benzena dan toluena pada suhu 25 °C berturut-turut adalah 95,1 mmHg dan 28,4 mmHg.
Kunci Jawaban :
Jika larutan terdiri atas dua komponen dengan jumlah fraksi mol yang sama, fraksi mol keduanya adalah 0,5.
Tekanan uap parsial :
= 0,5 × 95,1 mmHg = 47,6 mmHg
Tekanan uap total:
Jadi, tekanan uap parsial benzena dan toluena adalah 47,6 mmHg dan 14,2 mmHg, sedangkan tekanan uap total adalah 61,8 mmHg.
2. Kenaikan Titik Didih dan Penurunan Titik Beku
 |
| Gambar 2. Diagram fase air |
a. Kenaikan Titik Didih Air (
Titik didih zat cair adalah suhu tetap pada saat zat cair mendidih. Pada suhu ini, tekanan uap zat cair sama dengan tekanan udara di sekitarnya. Hal ini menyebabkan terjadinya penguapan di seluruh bagian zat cair. Titik didih zat cair diukur pada tekanan 1 atmosfer. Contohnya, titik didih air 100 °C, artinya pada tekanan udara 1 atm air mendidih pada suhu 100 °C.
Dari hasil eksperimen yang dilakukan pada penentuan titik didih larutan, ternyata titik didih larutan selalu lebih tinggi dari titik didih pelarut murninya. Hal ini disebabkan adanya partikel-partikel zat terlarut dalam suatu larutan menghalangi peristiwa penguapan partikel-partikel pelarut. Oleh karena itu, penguapan partikel-partikel pelarut membutuhkan energi yang lebih besar.
Perbedaan titik didih larutan dengan titik didih pelarut murni disebut kenaikan titik didih yang dinyatakan sebagai  (b berasal dari kata boil). Titik didih suatu larutan lebih tinggi atau lebih rendah daripada titik didih pelarut, bergantung pada kemudahan zat terlarut itu menguap dibandingkan dengan pelarutnya. Jika zat terlarut tersebut tidak mudah menguap, misalnya larutan gula, larutan tersebut mendidih pada suhu yang lebih tinggi daripada titik didih pelarut air. Sebaliknya, jika zat terlarut itu mudah menguap misalnya etanol, larutan akan mendidih pada suhu di bawah titik didih air.
(b berasal dari kata boil). Titik didih suatu larutan lebih tinggi atau lebih rendah daripada titik didih pelarut, bergantung pada kemudahan zat terlarut itu menguap dibandingkan dengan pelarutnya. Jika zat terlarut tersebut tidak mudah menguap, misalnya larutan gula, larutan tersebut mendidih pada suhu yang lebih tinggi daripada titik didih pelarut air. Sebaliknya, jika zat terlarut itu mudah menguap misalnya etanol, larutan akan mendidih pada suhu di bawah titik didih air.
Hukum sifat koligatif dapat diterapkan dalam meramalkan titik didih larutan yang zat terlarutnya bukan elektrolit dan tidak mudah menguap. Telah ditentukan secara eksperimen bahwa 1,00 mol (6,02 × 1023 molekul) zat apa saja yang bukan elektrolit dan tidak mudah menguap yang dilarutkan dalam (1.000 g) air akan menaikkan titik didih kira-kira 0,51 °C. Perubahan pelarut murni ke larutan, yakni ΔTb, berbanding lurus dengan molalitas (m) dari larutan tersebut:
Tabel 1. Tetapan Kenaikan Titik Didih ( ) Beberapa Pelarut
) Beberapa Pelarut
Pelarut | Titik didih (oC) | Kb (oC /m) |
Aseton | 56,2 | 1,71 |
Benzena | 80,1 | 02,53 |
kamfer | 204,0 | 05,61 |
Karbon tetraklorida | 76,5 | 04,95 |
Sikloheksana | 80,7 | 02,79 |
Naftalena | 217,7 | 05,80 |
Fenol | 182 | 03,04 |
Air | 100,0 | 00,52 |
Kb adalah tetapan kenaikan titik molal dari pelarut (°C/m). Kenaikan titik didih (ΔTb) adalah titik didih larutan (Tb) dikurangi titik didih pelarut murni (Tbo).
Contoh Soal 9 :
Hitunglah titik didih larutan yang mengandung 18 g glukosa, C6H12O6. (Ar C = 12 g/mol, Ar H = 1g/mol, dan Ar O = 16 g/mol) dalam 250 g air. (Kb air = 0,52 °C/m)
= 0,4 m
ΔTb = Kbm
ΔTb = 0,52 °C/m × 0,4 m
ΔTb = 0,208 °C
Titik didih larutan = 100 + ΔTb
Titik didih larutan = 100 °C + 0,208 °C
Titik didih larutan = 100,208 °C
Jadi, titik didih larutan adalah 100,208 °C.
Contoh Soal 10 :
Titik didih larutan yang mengandung 1,5 g gliserin dalam 30 g air adalah 100,28 °C. Tentukan massa molekul relatif gliserin. (Kbair = 0,52 °C/m)
Kunci Jawaban :
Titik didih larutan = 100 + ΔTb
100,28 = 100 + ΔTb
ΔTb = 0,28 °C
M = 92,8 g/mol
Jadi, massa molekul relatif gliserin adalah 92,8 g/mol.
b. Penurunan Titik Beku (ΔTf)
Seperti halnya pada kenaikan titik didih, adanya zat terlarut dalam larutan akan mengakibatkan titik beku larutan lebih kecil daripada titik beku pelarutnya. Penurunan titik beku, ΔTf (f berasal dari kata freeze) berbanding lurus dengan molalitas (m) larutan:
ΔTf ¥ m atau ΔTf = Kf m
dengan Kf adalah tetapan penurunan titik beku molal pelarut (°C/m). Penurunan titik beku (Tf) adalah titik beku pelarut murni (Tfo) dikurangi titik beku larutan (Tf).
ΔTf = ΔTfo - Tf
Berikut ini adalah beberapa harga tetapan penurunan titik beku (Kf) dari beberapa pelarut.
Pelarut | Titik beku (oC) | Kf(oC/m) |
Aseton | –95,35 | 2,40 |
Benzena | 5,45 | 5,12 |
Kamfer | 179,8 | 39,7 |
Karbon tetraklorida | –23 | 29,8 |
Sikloheksana | 6,5 | 20,1 |
Naftalena | 80,5 | 6,94 |
Fenol | 43 | 7,27 |
Air | 0 | 1,86 |
Contoh Soal 11 :
Berapakah titik beku larutan yang terbuat dari 10 g urea CO(NH2)2 dalam 100 g air? (massa molar urea 60 g/mol, Kf air = 1,86 °C/m)
Kunci Jawaban :
ΔTf =Kf m
ΔTf = 1,86 °C/m × 1,7 m
ΔTf = 3,16 °C
Jadi, larutan tersebut memiliki titik beku 3,16 °C di bawah 0 °C atau pada –3,16 °C.
Contoh Soal 12 :
Hitunglah titik beku larutan yang terdiri atas 10 gram glukosa (Mr = 180 g/mol) dalam 500 g air (Kf air = 1,86 °C/m).
Kunci Jawaban :
ΔTf = Kf m
ΔTf = 1,86 °C/m × 0,11 m
ΔTf = 0,20 °C
Titik beku larutan
ΔTf = Tf air – Tf larutan
0,20 °C = 0 – Tf larutan
Tf larutan = –0,20 °C
Jadi, titik beku larutan adalah –0,20 °C.
Contoh Soal 13 :
Hitunglah titik beku suatu larutan yang mengandung 2 g kloroform, CHCl3 (Mr = 119 g/mol) yang dilarutkan dalam 50 g benzena (Kf benzena = 5,12 °C/m, Tf benzena = 5,45 °C).
Kunci Jawaban :
ΔTf = Kf m
= 5,12 °C/m × 0,34 m
= 1,74 °C
Titik beku larutan
ΔTf = Tf benzena – Tf larutan
1,74 = 5,45 – Tf larutan
Tf larutan = 3,71 °C
Jadi, titik beku larutan tersebut adalah 3,71 °C.
Contoh Soal 14 :
Larutan yang dibuat dengan melarutkan 5,65 g suatu senyawa yang tidak diketahui dalam 110 g benzena membeku pada 4,39 °C. Berapakah massa molar senyawa tersebut?
Kunci Jawaban :
Pada Tabel 2. diketahui titik beku benzena = 5,45 °C dan Kf benzena = 5,12 °C/m
ΔTf = 5,45 °C – 4,39 °C = 1,06 °C
ΔTf = Kf m
0,207 m artinya setiap kg benzena pada larutan mengandung 0,207 mol zat terlarut maka jumlah mol pada 110 g benzena dapat dihitung.
Jadi, massa 1 mol zat terlarut tersebut adalah 245,65 g.
Gejala penurunan titik beku juga memiliki terapan praktis di antaranya adalah penurunan titik beku air. Zat antibeku (biasanya etilen glikol) yang ditambahkan ke dalam sistem pendingin mesin mobil mencegah pembekuan air radiator pada musim dingin. Penggunaan CaCl2 dan NaCl untuk menurunkan titik leleh es juga sering diterapkan, misalnya untuk menyiapkan campuran pendingin dalam pembuatan es krim. Contoh penerapan Hukum Raoult digunakan pada alat distilasi untuk memisahkan campuran berdasarkan perbedaan titik didihnya.
 |
| Gambar 3. Alat distilasi dirancang menggunakan prinsip hukum Raoult. |
3. Tekanan Osmotik
Osmosis adalah merembesnya partikel-partikel pelarut dari larutan yang lebih encer ke larutan yang lebih pekat melalui suatu membran semipermeabel. Membran semipermiabel hanya melewatkan molekul zat tertentu sementara zat yang lainnya tertahan.
Perhatikanlah Gambar 4, gambar tersebut memperlihatkan larutan A dan larutan B dengan konsentrasi yang berbeda yang dipisahkan oleh suatu membran semipermeabel yang hanya dapat ditembus oleh molekul air.
 |
| Gambar 4. Proses osmosis dengan membran semi permeabel |
Gambar 4. menggambarkan peristiwa osmosis. Pada Gambar 4a, diperlihatkan keadaan awal, kemudian setelah beberapa saat, tinggi air pada tabung naik (Gambar 4b) hingga kesetimbangan tercapai. Tekanan balik dibutuhkan untuk mencegah terjadinya proses osmosis (Gambar 4c). Jumlah tekanan balik yang dibutuhkan merupakan tekanan osmotik larutan.
Dua larutan yang memiliki tekanan osmotik sama disebut larutan isotonik. Jika salah satu larutan memiliki tekanan osmotik lebih tinggi dari larutan yang lainnya, larutan tersebut dinamakan hipertonik. Adapun jika larutan memiliki tekanan osmotik lebih rendah dari larutan yang lainnya, larutan tersebut dinamakan hipotonik.
Tekanan osmotik termasuk dalam sifat-sifat koligatif karena besarnya hanya bergantung pada jumlah partikel zat terlarut persatuan volume larutan. Tekanan osmotik tidak tergantung pada jenis zat terlarut. Persamaan berikut (dikenal sebagai Persamaan Van’t Hoff) digunakan untuk menghitung tekanan osmotik dari larutan encer.
p = MRT
Keterangan:
π = tekanan osmotik (atm)
R = tetapan gas (0,082 L atm/mol K)
M = molaritas larutan
T = suhu (Kelvin)
Contoh Soal 15 :
Berapakah tekanan osmotik pada 25 °C dari larutan sukrosa (C12H22O11) 0,001 M?
Kunci Jawaban :
Diketahui :
T = 25 °C = (25 + 273) K = 298 K
M = 0,001 mol/L
R = 0,082 L atm/mol K
π = MRT
π = 0,001 mol/L × 0,082 L atm/mol K × 298 K = 0,024 atm
Jadi, tekanan osmotik larutan tersebut adalah 0,024 atm.
Contoh Soal 16 :
Dalam larutan encer, 0,001 M gula dalam air dipisahkan dari air murni dengan menggunakan membran osmosis. Berapakah tekanan osmotik dalam torr pada suhu 25 °C?
Kunci Jawaban :
π = MRT
π = (0,001 mol/L) (0,0821 L atm/mol K) (298 K) = 0,0245 atm
Jadi, tekanan osmotik 0,001 M gula dalam air adalah 18,6 torr.
Contoh Soal 17 :
Suatu larutan dengan volume 100 mL mengandung 0,122 g zat nonelektrolit terlarut dan memiliki tekanan osmotik 16 torr pada suhu 20 °C. Berapakah massa molar zat terlarut tersebut?
Kunci Jawaban :
T dalam kelvin = (273 + 20) = 293 K
p = MRT
0,0211 atm = (M) (0,082 L atm/mol K) (298 K)
n = M × V
n = 8,63 × 10–5 mol
Jadi, massa molar zat terlarut tersebut adalah 1,41 × 103 g/mol.
Contoh Soal 18 :
Kunci Jawaban :
Tekanan osmotik (π ) dikonversikan terlebih dahulu menjadi atm.




Jadi, massa molekul relatif albumin adalah 6,86 × 104 g/mol.
Jika tekanan mekanis pada suatu larutan melebihi tekanan osmotik, pelarut murni akan terperas ke luar dari suatu larutan lewat suatu membran semipermeabel (Gambar 6).
Proses ini disebut osmosis terbalik (reverse osmosis) dan merupakan suatu cara untuk memulihkan pelarut murni dari dalam suatu larutan. Contoh penerapan osmosis balik adalah pemulihan air murni dari limbah industri dan menawarkan air laut (desalinasi).
Proses osmosis sangat penting bagi tanaman dan hewan karena dengan proses osmosis, air dibagikan ke semua sel organisme hidup. Dinding sel merupakan membran semipermeabel, membran sel hidup ini juga dapat ditembus oleh zat-zat terlarut tertentu sehingga bahan makanan dan produk buangan dipertukarkan lewat dinding sel ini. Permeabilitas dinding sel terhadap zat terlarut seringkali bersifat memilih-milih dan sampai batas tertentu tidak bergantung pada ukuran partikel zat terlarut dan konsentrasi mereka. Misalnya, ion magnesium yang terhidrasi praktis tidak menembus dinding saluran pencernaan, sedangkan molekul glukosa dapat melewati.
C. Sifat Koligatif Larutan Elektrolit
Jika zat terlarut membentuk larutan bersifat asam, basa, dan garam, ternyata rumus-rumus sifat koligatif larutan memiliki nilai yang tidak sama dengan data percobaan. Harga-harga ΔP, ΔTb , ΔTf , dan π dari larutanlarutan asam, basa, dan garam yang diamati melalui eksperimen selalu lebih besar daripada harga-harga yang dihitung menurut perhitungan ideal.
Menurut Arrhenius, suatu zat elektrolit yang dilarutkan dalam air akan terurai menjadi ion-ion penyusunnya sehingga jumlah partikel zat pada larutan elektrolit akan lebih banyak dibandingkan dengan larutan nonelektrolit yang konsentrasinya sama. Hal ini menyebabkan sifat koligatif pada larutan elektrolit lebih besar daripada larutan nonelektrolit.
Perilaku elektrolit dapat digambarkan dengan memerhatikan fenomena di atas. Penurunan titik beku ΔTf arutan 0,005 m NaCl 1,96 kali (2 kali) ΔTf glukosa sebagai zat nonelektrolit, demikian juga ΔTf untuk K2SO4 hampir 3 kali dari ΔTf glukosa. Keadaan ini dapat dinyatakan dengan persamaan berikut.
Hubungan sifat koligatif larutan elektrolit dan konsentrasi larutan dirumuskan oleh Van’t Hoff, yaitu dengan mengalikan rumus yang ada dengan bilangan faktor Van’t Hoff yang merupakan faktor penambahan jumlah partikel dalam larutan elektrolit.
Keterangan :
i = faktor yang menunjukkan bagaimana larutan elektrolit dibandingkan dengan larutan nonelektrolit dengan molalitas yang sama. Faktor i inilah yang lebih lanjut disebut faktor Van’t Hoff.
n = jumlah ion dari elektrolit
α = derajat ionisasi elektrolit
Contoh elektrolit biner :
NaCl(s) →Na+(aq) + Cl–(aq)................................................(n = 2)
KOH(s) →K+(aq) + OH–(aq)...............................................(n = 2)
Contoh elektrolit terner :
H2SO4(l) + 2 H2O(l) →2 H3O+(aq) + SO4 2–(aq)................(n = 3)
Mg(OH)2(s) →Mg2+(aq) + 2 OH–(aq)..................................(n = 3)
Contoh elektrolit kuarterner :
K3PO4(s) →3 K+(aq) + PO4 3–(aq).....................................(n = 4)
AlBr3(s) →Al3+(aq) + 3 Br–(aq)............................................(n = 4)
Untuk larutan elektrolit berlaku Hukum Van’t Hoff
1. Penurunan Tekanan Uap Jenuh
Rumus penurunan tekanan uap jenuh dengan memakai faktor Van’t Hoff hanya berlaku untuk fraksi mol zat terlarutnya saja (zat elektrolit yang mengalami ionisasi), sedangkan pelarut air tidak terionisasi. Oleh karena itu, rumus penurunan tekanan uap jenuh untuk zat elektrolit adalah :
Contoh Soal 18 :
Suatu larutan dibuat dengan melarutkan 1,08 g protein, yaitu serum albumin manusia yang diperoleh dari plasma darah (dalam 50 cm3 air). Larutan menunjukkan tekanan osmotik 5,85 mmHg pada 298 K. Tentukan massa molekul relatif albumin.
Kunci Jawaban :
Tekanan osmotik (π ) dikonversikan terlebih dahulu menjadi atm.
Jadi, massa molekul relatif albumin adalah 6,86 × 104 g/mol.
Jika tekanan mekanis pada suatu larutan melebihi tekanan osmotik, pelarut murni akan terperas ke luar dari suatu larutan lewat suatu membran semipermeabel (Gambar 6).
 |
| Gambar 6. Osmosis terbalik, menunjukkan jika tekanan mekanis lebih besar daripada tekanan osmotik , pelarut dipaksa melewati membran semipermeabel dari dalam larutan menuju ke pelarut murni. |
Proses osmosis sangat penting bagi tanaman dan hewan karena dengan proses osmosis, air dibagikan ke semua sel organisme hidup. Dinding sel merupakan membran semipermeabel, membran sel hidup ini juga dapat ditembus oleh zat-zat terlarut tertentu sehingga bahan makanan dan produk buangan dipertukarkan lewat dinding sel ini. Permeabilitas dinding sel terhadap zat terlarut seringkali bersifat memilih-milih dan sampai batas tertentu tidak bergantung pada ukuran partikel zat terlarut dan konsentrasi mereka. Misalnya, ion magnesium yang terhidrasi praktis tidak menembus dinding saluran pencernaan, sedangkan molekul glukosa dapat melewati.
C. Sifat Koligatif Larutan Elektrolit
Jika zat terlarut membentuk larutan bersifat asam, basa, dan garam, ternyata rumus-rumus sifat koligatif larutan memiliki nilai yang tidak sama dengan data percobaan. Harga-harga ΔP, ΔTb , ΔTf , dan π dari larutanlarutan asam, basa, dan garam yang diamati melalui eksperimen selalu lebih besar daripada harga-harga yang dihitung menurut perhitungan ideal.
Menurut Arrhenius, suatu zat elektrolit yang dilarutkan dalam air akan terurai menjadi ion-ion penyusunnya sehingga jumlah partikel zat pada larutan elektrolit akan lebih banyak dibandingkan dengan larutan nonelektrolit yang konsentrasinya sama. Hal ini menyebabkan sifat koligatif pada larutan elektrolit lebih besar daripada larutan nonelektrolit.
Perilaku elektrolit dapat digambarkan dengan memerhatikan fenomena di atas. Penurunan titik beku ΔTf arutan 0,005 m NaCl 1,96 kali (2 kali) ΔTf glukosa sebagai zat nonelektrolit, demikian juga ΔTf untuk K2SO4 hampir 3 kali dari ΔTf glukosa. Keadaan ini dapat dinyatakan dengan persamaan berikut.
ΔTf elektrolit = i × ΔTf nonelektrolit
Hubungan sifat koligatif larutan elektrolit dan konsentrasi larutan dirumuskan oleh Van’t Hoff, yaitu dengan mengalikan rumus yang ada dengan bilangan faktor Van’t Hoff yang merupakan faktor penambahan jumlah partikel dalam larutan elektrolit.
i = 1 + (n – 1)α
Keterangan :
i = faktor yang menunjukkan bagaimana larutan elektrolit dibandingkan dengan larutan nonelektrolit dengan molalitas yang sama. Faktor i inilah yang lebih lanjut disebut faktor Van’t Hoff.
n = jumlah ion dari elektrolit
α = derajat ionisasi elektrolit
Contoh elektrolit biner :
NaCl(s) →Na+(aq) + Cl–(aq)................................................(n = 2)
KOH(s) →K+(aq) + OH–(aq)...............................................(n = 2)
Contoh elektrolit terner :
H2SO4(l) + 2 H2O(l) →2 H3O+(aq) + SO4 2–(aq)................(n = 3)
Mg(OH)2(s) →Mg2+(aq) + 2 OH–(aq)..................................(n = 3)
Contoh elektrolit kuarterner :
K3PO4(s) →3 K+(aq) + PO4 3–(aq).....................................(n = 4)
AlBr3(s) →Al3+(aq) + 3 Br–(aq)............................................(n = 4)
Untuk larutan elektrolit berlaku Hukum Van’t Hoff
1. Penurunan Tekanan Uap Jenuh
Rumus penurunan tekanan uap jenuh dengan memakai faktor Van’t Hoff hanya berlaku untuk fraksi mol zat terlarutnya saja (zat elektrolit yang mengalami ionisasi), sedangkan pelarut air tidak terionisasi. Oleh karena itu, rumus penurunan tekanan uap jenuh untuk zat elektrolit adalah :
ΔP = XBP° {1 + (n – 1)α }
Perhatikanlah contoh soal penerapan rumus tekanan uap untuk zat elektrolit berikut .
Contoh Soal 19 :
Hitunglah tekanan uap larutan NaOH 0,2 mol dalam 90 gram air jika tekanan uap air pada suhu tertentu adalah 100 mmHg.
Kunci Jawaban :
Karena NaOH merupakan elektrolit kuat (α = 1) dan n = 2 maka
ΔP = P°XB {1 + (n – 1)α }
ΔP = 100 × 0,038 {1 + (2 – 1)1}
ΔP = 7,6 mmHg
Tekanan uap larutan = 100 mmHg – 7,6 mmHg = 92,4 mmHg
Jadi, tekanan uap larutan NaOH adalah 92,4 mmHg.
2. Kenaikan Titik Didih dan Penurunan Titik Beku
Seperti halnya penurunan tekanan uap jenuh, rumus untuk kenaikan titik didih dan penurunan titik beku untuk larutan elektrolit juga dikalikan dengan faktor Van't Hoff.
Perhatikanlah contoh-contoh soal berikut.
Contoh Soal 20 :
Sebanyak 4,8 gram magnesium sulfat, MgSO4 (Mr = 120 g/mol) dilarutkan dalam 250 g air. Larutan ini mendidih pada suhu 100,15 °C. Jika diketahui Kb air 0,52 °C/m, Kf air = 1,8 °C/m, tentukan:
a. derajat ionisasi MgSO4;
b. titik beku larutan.
Kunci Jawaban :
a. Reaksi ionisasi MgSO4 adalah MgSO4(s) → Mg2+(aq) + SO4 2–(aq)..............(n = 2)
Kenaikan titik didih :
ΔTb = Tb larutan – Tb air
ΔTb = 100,15 °C – 100 °C = 0,15 °C
ΔTb = Kb.m.i
α = 0,8
Jadi, derajat ionisasi MgSO4 adalah 0,8.
b. Untuk menghitung titik bekunya, kita cari dulu penurunan titik bekunya dengan rumus:
Tf larutan = Tf air – ΔTf
Tf larutan = 0 °C – 0,52 °C = –0,52 °C
Jadi, titik beku larutan tersebut adalah –0,52 °C.
3. Tekanan Osmotik
Tekanan osmotik untuk larutan elektrolit diturunkan dengan mengalikan faktor van't Hoff.
Perhatikanlah contoh-contoh soal berikut.
Contoh Soal 21 :
Sebanyak 5,85 gram NaCl (Mr = 58,5 g/mol) dilarutkan dalam air sampai volume 500 mL. Hitunglah tekanan osmotik larutan yang terbentuk jika diukur pada suhu 27 °C dan R = 0,082 L atm/mol K.
Kunci Jawaban :
diketahui, NaCl (n = 2) dan α = 1
π = M R T i
α = 0,016
Jadi, derajat ionisasi larutan tersebut adalah 0,016.
Rangkuman :
1. Molalitas adalah besaran yang berguna untuk menghitung jumlah zat terlarut yang dinyatakan dalam mol dan jumlah pelarut dalam kilogram.
2. Fraksi mol merupakan satuan konsentrasi yang semua komponen larutannya dinyatakan berdasarkan mol. Total fraksi mol = 1
3. Sifat koligatif bergantung pada jumlah zat yang terlarut pada larutan. Sifat koligatif terdiri atas penurunan tekanan uap (ΔP), kenaikan titik didih (ΔTb) dan penurunan titik beku (ΔTf), dan tekanan osmotik.
a. Penurunan tekanan uap (ΔP)
b. Kenaikan titik didih (ΔTb) dan penurunan titik beku (ΔTf)
c. Tekanan osmotik (π )
π =MRT
4. Sifat koligatif larutan elektrolit bergantung pada bilangan faktor Van’t Haff. Jadi, perhitungan penurunan tekanan uap, kenaikan titik didih, dan tekanan osmotik dikalikan dengan faktor Van’t Hoff (i).
i = 1 + (n – 1)α
Anda sekarang sudah mengetahui Sifat Koligatif Larutan. Terima kasih anda sudah berkunjung ke Perpustakaan Cyber.
Referensi :
Rahayu, Imam. 2009. Praktis Belajar Kimia untuk Kelas XII Sekolah Menengah Atas/Madrasah Aliyah Program Ilmu Pengetahuan Alam. Pusat Perbukuan, Departemen Pendidikan Nasional, p. 194.
Tidak ada komentar:
Posting Komentar